무한한 희망의 에너지
- 작성일 2018.07.23
- 조회수 16268
by 최원석(과학 컬럼리스트) 1937년 독일의 비행선 힌덴부르크호는 미국의 계류장에서 발생한 사고로 탑승자 전원이 사망하는 참사를 겪는다. 비행선의 공기를 담는 기낭이 헬륨이 아니라 수소로 가득 채워져 생긴 사고였다. 1952년에는 에니웨톡 환초에서 미국의 수소 폭탄 실험이 이뤄졌고, 소련도 다음해에 더 큰 위력의 수소 폭탄 실험을 한다. 이처럼 과거에는 수소가 비극과 두려움의 상징이었던 시절이 있었다. 하지만 이제 수소는 인류에게 희망을 주는 무한의 에너지로 다시 돌아왔다. 칠흑같이 어두운 밤하늘에서 반짝이는 별빛처럼 수소는 세상을 빛나게 할 미래 에너지로 주목 받고 있는 것이다. 그렇다면 수소가 어떻게 인류의 희망이 될 수 있는 것일까 ? 흔하지만 흔하지 않은 수소
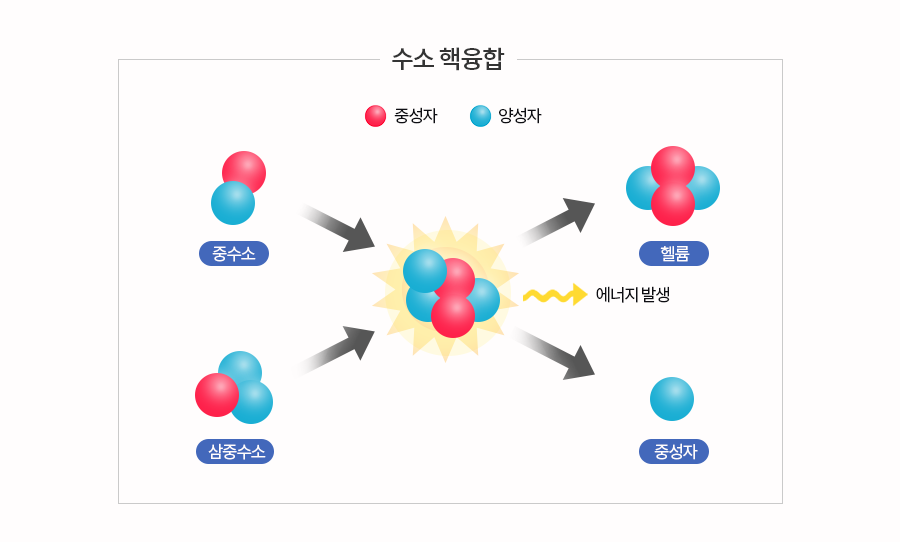
<스파이더맨>에 등장하는 전형적인 매드 사이언티스트(Mad scientist) 닥터 옥터퍼스. 물론 옥터퍼스도 처음부터 미치광이 과학자였던 것은 아니다. 수소 핵융합 실험 도중 발생한 사고로 인해 인공지능 로봇 팔이 몸과 융합되면서부터 그렇게 된 거다. 인류의 에너지 문제를 해결하기 위해 노력하다 사고를 당한 비운의 과학자인 셈이다. (*수소 핵융합: 수소의 동위원소인 중수소와 삼중수소가 융합해 무거운 헬륨 원자가 되면서 엄청난 에너지 발생) 옥터퍼스가 꿈꾼 수소 핵융합을 실현시키기는 쉽지 않지만 과학자들은 수소를 에너지원으로 활용할 수 있는 다양한 방법에 도전하고 있고 있다. 수소가 우주를 아름답게 빛내주듯 인류의 미래를 밝히려하는 것이다.
수소는 우주에 존재하는 원자 수의 90%, 질량의 75%를 차지할 정도로 풍부하다. 하지만 우리 주변에서 수소 분자를 찾기란 쉽지 않다. 수소를 찾기 힘들다니 무슨 소리냐고 반문할지도 모른다. 지구에서 가장 풍부한 물질 중 하나인 물속에 수소가 들어있기 때문이다. 물론 물에 수소가 있지만 그 수소는 산소와 화학결합에 의해 화합물의 상태로 존재하는 것이다. 수소 분자가 아니라는 것이다.
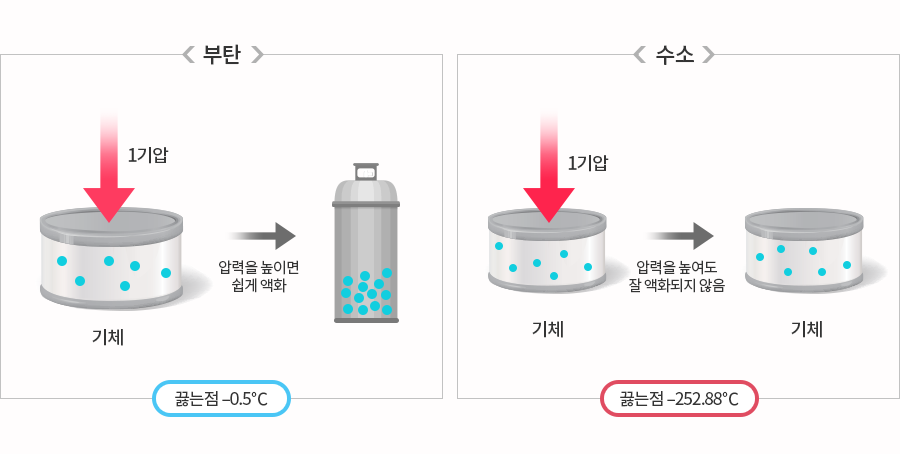
그렇다면 굳이 수소 분자를 고집하는 이유는 무엇일까? 분자 상태의 수소와 화합물 속의 수소는 성질이 전혀 달라서 물속의 수소는 에너지로 사용할 수 없기 때문이다. 따라서 우리에게 필요한 것은 분자 상태의 수소다. 우리 주변에는 분자 상태의 수소를 찾기 쉬우면 좋겠지만 아쉽게도 수소 분자는 찾기 어렵다. 수소는 물질 중에서 밀도가 가장 낮아서 생성된 수소는 대기 상층부로 올라가고 일부는 우주로 빠져나가 버린다. 그래서 대기 중에는 0.5ppm의 미량밖에 존재하지 않는다. 그렇다고 액체나 고체 상태의 수소는 더욱 만나기 어렵다. 수소는 끓는점(액체에서 기체로 물질의 상태가 변화하는 온도)도 –252.88℃(1기압)로 매우 낮기 때문이다. 그래서 액체나 고체 상태는 볼 수 없고 대기압 하에서는 항상 기체 상태로 존재한다. 우리가 접할 수 있는 수소는 화합물 형태의 수소인 물과 탄화수소이다. 따라서 수소분자를 얻으려면 화합물을 분해해야 한다. 팔방미인 수소
지상에서는 대부분의 수소가 화합물로 이뤄져 있어 18세기 말에서야 그 존재가 알려졌다. 1783년 프랑스 화학자 라부아지에(A. L. Lavoisier)는 수소가 탈 때 물이 생성된다는 것을 확인 하고, ‘물을 생성하는 것’이라는 뜻으로 ‘hydrogen’이라고 명명했다. 힌덴부르크호 사고에서 알 수 있는 것과 같이 수소는 공기와 섞여있을 때 연소시키면 폭발적으로 반응하여 물과 열이 발생하거나 전기를 얻을 수도 있다. 이와 같이 수소는 반응시키는 방법에 따라 열과 전기를 동시에 얻을 수 있어 수송 분야뿐만 아니라 산업이나 가정에서도 사용할 수 있는 활용도가 높은 에너지다. 그리고 무엇보다 중요한 것은 반응 과정에서 생성되는 폐기물이 물 밖에 없다는 것이다. 그래서 수소를 미래의 무한 청정에너지라고 하는 것이다.
수소는 전기에 비해 저장이 용이하고 수송도 쉽지만 폭발 가능성 때문에 사용상 주의가 필요하다. 수소는 보관이 까다로워 아직까지는 부탄가스처럼 소형 용기에 담아서 사용할 수는 없다. 부탄은 끓는점이 -0.5℃(1기압)로 높아서 압력을 조금만 높여도 액화되어 용기에 넣을 수 있지만 끓는점이 낮은 수소는 압력을 높여도 쉽게 액체 상태로 되지 않는다. 그래서 수소 분자 상태로 저장하지 않고 질소와 결합한 화합물인 암모니아(NH3)의 형태로 저장하고 사용하기도 한다. 암모니아는 끓는점이 –33.3℃(1기압)으로 쉽게 액화 가능하기 때문이다. 또한 메탄올(CH3OH)이나 에탄올(C2H5OH)처럼 수소를 많이 포함한 탄화수소의 형태로도 사용한다. 수소는 열 에너지원로서도 안성맞춤이지만 현재 가장 주목 받는 분야는 수소연료전지 분야다. 특히 수소연료전지 자동차의 경우 모터를 구동하는데 필요한 전력을 수소에서 얻는다. 물론 수소차가 친환경 자동차라고 하더라도 폭발 사고 때문에 꺼려지는 것은 사실이다. 하지만 충돌로 인해 내연기관 자동차의 연료탱크가 폭발할 정도라도 수소탱크는 폭발하지 않을 정도로 안전하다.
영화에서 자동차의 연료탱크를 총으로 쏘면 자동차가 폭발하는 장면을 종종 볼 수 있지만 오히려 수소 자동차는 총으로 쏴도 버너처럼 불꽃만 뿜어져 나올 뿐 폭발하지는 않는다. 수소를 활용하기 위해서 수소저장 용기의 안전성 확보가 가장 중요하기 때문이다. 수소 생산 101
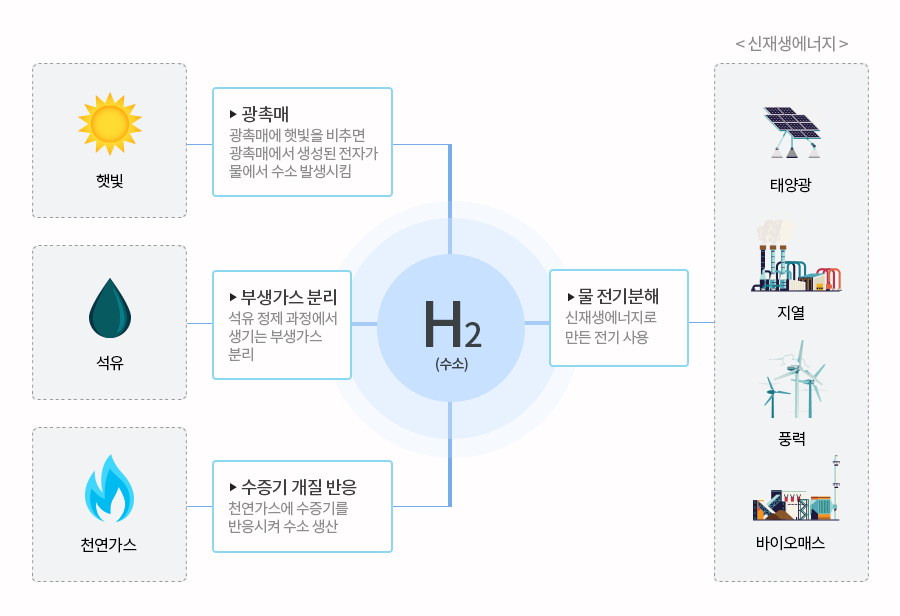
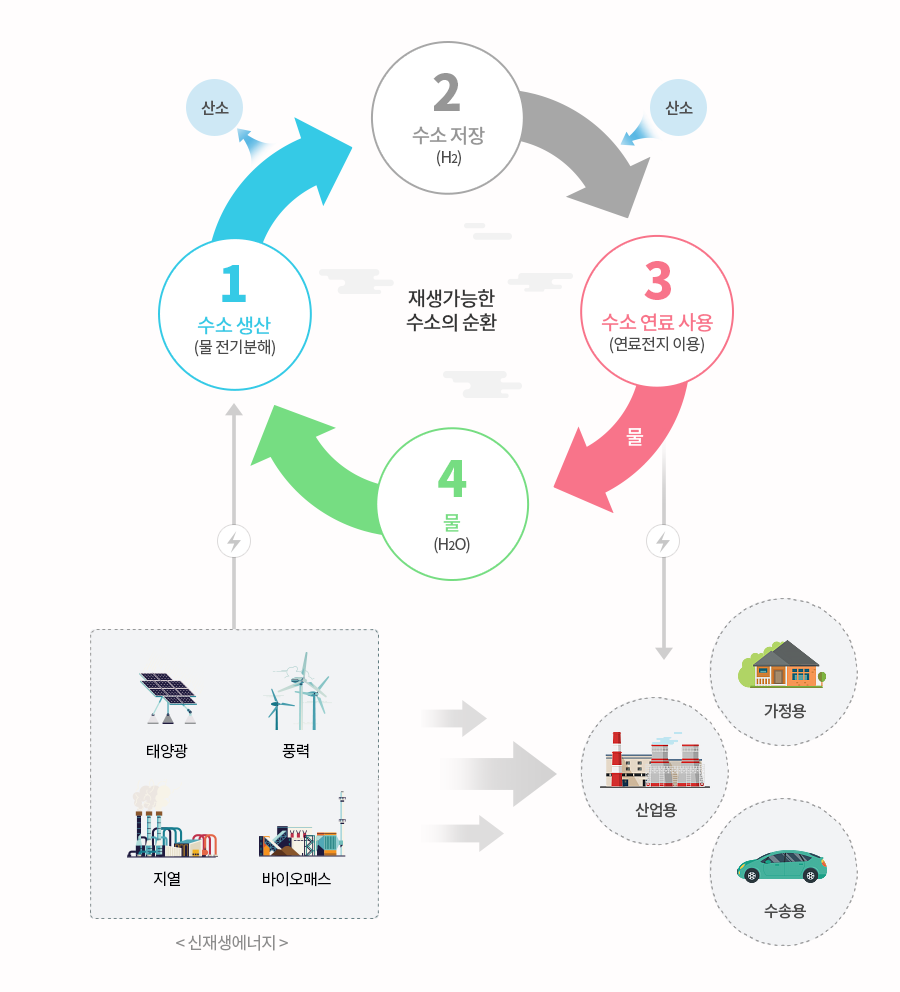
수소 자동차 이외에도 수소는 다양한 활용성과 환경성으로 인해 미래의 에너지로 주목 받고 있다. 문제는 수소를 생산하는 방법이다. 물을 전기분해하면 수소를 쉽게 얻을 수 있지만 이 때 전력이 화력발전에서 생산된 것이라면 수소는 전혀 친환경적인 에너지가 아닌 게 된다. 따라서 수소를 생산할 때 어떤 에너지를 사용하는지에 따라 친환경에너지가 될 수도 있고 그렇지 않을 수도 있다. 즉 물과 탄화수소와 같은 화합물 속에 풍부하게 존재하는 수소를 분자 상태로 분리해 내는 효율적인 방법을 찾아내는 것은 수소 에너지 활용에 있어 가장 중요한 사항이다.
화학결합을 끊고 화합물에서 수소를 분리해 내려면 에너지가 필요하다. 이때 수소를 얻기 위한 에너지가 수소로부터 얻을 수 있는 에너지 보다 큰 방법은, 경제성이 없어 상용화되긴 어렵다. 따라서 물을 전기분해하거나 고온으로 가열하면 수소를 쉽게 얻을 수 있지만 전기분해와 고온가열 모두 에너지가 많이 소모된다는 단점이 있다. 따라서 전기분해에 필요한 전력은 태양광이나 풍력, 수력 등의 신재생에너지를 활용해야 한다. 또한 열에너지는 원자력 발전처럼 부차적으로 발생하는 열에너지를 활용하면 된다. 물론 이 방법은 원자력 발전소가 가동되어야 활용될 수 있다는 문제를 지니고 있지만 현재는 폐열을 활용한다는 측면에서 보면 친환경적인 방법이라 할 수 있다.
이산화티타늄(TiO2)과 같은 광촉매(촉매는 직접 화학반응에 참여하지 않지만 화학반응을 도와주는 물질. 촉매가 있으면 화학반응에 필요한 에너지를 낮출 수 있어 반응속도가 증가한다)를 이용해 물에서 수소를 얻을 수도 있다. 즉 물속 수소이온(H+)이 광촉매의 도움으로 전자를 얻어 수소 원자가 된 후 수소 원자끼리 결합하면 수소분자가 생성된다. 넓은 스펙트럼 영역에서 수소를 생산할 수 있는 광촉매를 개발하게 되면 수소 생산 비용이 낮아진다. 현재 수소는 화석연료의 수증기 개질(reforming, 메탄과 수증기를 가열하고 반응시켜 수소를 얻는 방법으로 부산물로 이산화탄소가 발생한다)을 통해 많이 생산한다. 하지만 더 저렴한 비용으로 태양열이나 미생물, 매립지의 메탄가스 등에서도 수소를 생산하게 되면 ‘수소 에너지의 시대’가 펼쳐지는 것도 시간문제일 뿐이다. |
전체 10건의 게시물이 조회되었습니다.